식품의약품안전처(처장 류영진)는 경피용건조비씨지백신 '첨부용제'에서 품질 기준 이상의 비소가 검출돼 회수 진행 중이라고 9일 밝혔다.
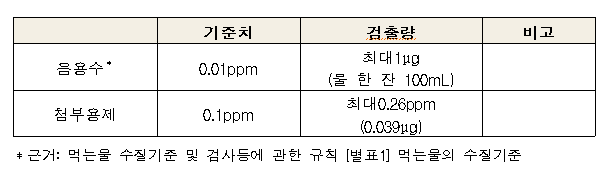
일본 후생성 발표에 따르면, 회수 대상인 경피용비씨지백신에서는 비소가 검출되지 않았으나 첨부용제에서 대한민국약전 및 일본약전에서 정하고 있는 첨부용제의 비소기준(0.1ppm 이하)을 초과해 최대 '0.26ppm' 검출돼 품질기준을 벗어난 것이다.
비소는 유독성 물질로 잘 알려져 있으나, 물, 공기, 토양 등 자연계에 널리 분포하는 물질로 일상에서 접하는 환경과 식품에도 낮은 농도로 존재하고 있다.
또한, 회수 대상인 경피용비씨지백신의 검출된 비소 최고량인 0.26ppm(0.039㎍)은 국제가이드라인에서 제시하는 주사제의 매일 허용 노출량(1.5㎍, 체중 5㎏ 기준)의 1/38에 해당하는 양이다.
특히 가이드라인에서 정한 매일 허용 노출량은 매일 투여하는 것을 기준으로 하는 것인데 비씨지백신은 평생 1회만 접종하고, 투여방법 상 약액을 피부에 도포해 접종용 침으로 누르는 방식이므로 소량만이 피부로 들어가게 되며, 미국 독성물질 질병 등록국 자료에 따르면 비소는 72시간 이내에 대부분 소변을 통해 배출된다.
이러한 점 등을 고려할 때 검출된 비소로 인한 위험성은 거의 없는 수준이며, 이미 접종을 받고 1개월 이상이 지난 아이들은 안전하다고 할 수 있다.
따라서, 품질 기준을 벗어난 의약품은 법령에서 회수하는 것을 원칙으로 정하고 있기 때문에 비소에 의한 위해성이 없다고 판단하고도 회수하는 것이며, 이것은 우수한 품질의 의약품이 공급될 수 있도록 하는 기본적인 규칙이라고 할 수 있다.
식약처 관계자는 "이번 회수조치는 품질 기준 위반 및 국민 불안감 해소 차원이며, 첨부용액에 함유된 비소의 안전성 문제로 인한 것이 아님을 알려드린다"고 말했다.
또한 "식약처는 일본의 검사결과와 별개로 자체적인 검사를 실시하고 있으며, 제조(수입)사의 품질관리를 통해 검증하던 '첨부용제'도 향후 품질검사방안을 적극 마련할 계획"이라고 밝혔다.
<엄지연 기자>
